传统的细菌治疗在癌症治疗中面临着安全性和有效性之间的平衡问题。虽然一些细菌,如沙门氏菌,因其能够在肿瘤微环境中选择性增殖而被研究用于癌症治疗,但它们作为异源微生物,可能会引发宿主的免疫反应,导致治疗效果受限。此外如何确保细菌在肿瘤组织中的有效富集,同时减少对正常组织的损害,也是一大挑战。研究者们采用了液氮冷冻休克技术处理含有减毒沙门氏菌VNP20009的巨噬细胞。这种方法能够在不破坏细胞结构的前提下,使巨噬细胞失去活性,同时保持内部细菌的活性。通过这种方式,细菌被有效地伪装在巨噬细胞内部,从而在避免初始免疫清除的同时,能够被运输到肿瘤组织中。实验结果表明,经过冷冻休克处理的巨噬细胞(LNT MACS/VNP)能够在肿瘤组织中实现细菌的有效富集。这种伪装策略减少了细菌被循环系统中的中性粒细胞清除的风险,并且由于巨噬细胞的自然趋向性,增强了细菌在肿瘤中的积累。此外这种策略还激活了肿瘤微环境中的抗肿瘤免疫反应,包括增加抗肿瘤效应细胞的数量和减少免疫抑制细胞的数量。
本研究提供了一种新的策略,通过利用巨噬细胞作为载体,将减毒细菌有效地输送到肿瘤组织中,同时激活抗肿瘤免疫反应。这种方法不仅提高了治疗效果,而且减少了传统细菌治疗可能引起的副作用,为癌症治疗提供了新的可能性。
Bioscreen全自动生长曲线分析仪的应用
用于实时监测不同条件下细菌(如减毒沙门氏菌VNP20009及其变体)在LB培养基中的生长情况。使用Bioscreen全自动生长曲线分析仪监测不同菌株在LB培养基中的生长条件。在两次传代培养后激活的VNP菌株被调整至OD600为1.0。然后,将10μL细菌悬浮液添加到1mL LB培养基中。充分混合后,将300μL溶液添加至Bioscreen C微孔板的孔中。将微孔板在37°C下孵育30小时,以30分钟的间隔进行连续OD600测量。通过连续测量培养液的吸光度(OD600),可以获取细菌生长曲线,从而评估细菌的生长速率和生长阶段。
实验结果
通过液氮冷冻休克处理含有减毒沙门氏菌VNP20009的巨噬细胞株,制备出“死亡”但“功能性”的沙门氏菌加载巨噬细胞。这些处理后的巨噬细胞保持了完整的细胞结构,失去了原有的致病性,而内部的细菌保留了原有的生物活性,并能在体内延迟释放和增殖。这种“特洛伊木马”策略有效避免了细菌免疫原性引起的中性粒细胞招募和激活,减少了细菌被中性粒细胞清除,增强了细菌在肿瘤中的富集效率。此外,这种策略还激活了肿瘤微环境,提高了抗肿瘤效应细胞(包括M1型巨噬细胞和CD8+Teffs)的数量,减少了促肿瘤效应细胞(包括M2型巨噬细胞和CD4+Tregs)的数量,并最终在皮下H22荷瘤小鼠模型中提高了抗肿瘤效果。

图1、装载VNP菌株的冷冻休克巨噬细胞的制备和表征。a)LNT MACS/VNP细胞制备过程示意图。b)与VNP菌株(MACS+VNP)共培养的巨噬细胞(MACS)的明场图片。赫斯特标记细胞核(蓝色)。红色箭头表示VNP菌株。比例尺=10μm。c)随着细胞与菌株共培养的时间,MACS中细胞内加载的活VNP菌株的数量以及形态完整的MACS的百分比发生变化(n=5)。d)Live MACS、Live MACS/VNP细胞和LNT MACS/VNP细胞的荧光图像。FITC-鬼笔环肽标记肌动蛋白(绿色);DAPI标记细胞核(蓝色)。红色箭头表示细胞内VNP-RFP菌株。比例尺=20μm。e)活MACS/VNP和LNT MACS/VNP细胞的明场图片。赫斯特标记细胞核(蓝色)。白色箭头表示VNP菌株(表达红色荧光蛋白的菌株)。比例尺=5μm。f)使用扫描电子显微镜(SEM)观察不同细胞的形态。比例尺=5μm。g)显示了LNT MACS和LNT MACS/VNP-RFP的相对平均荧光强度(MFI)。au,任意单位。h)Live MACS和LNT MACS增殖活性比较示意图。i)Live MACS和LNT MACS的体内增殖活性比较(右)。百分比值总结自三个独立实验(每个独立实验每组n=5只小鼠)。显示了质量生成的代表性解剖学观察图像(左)。
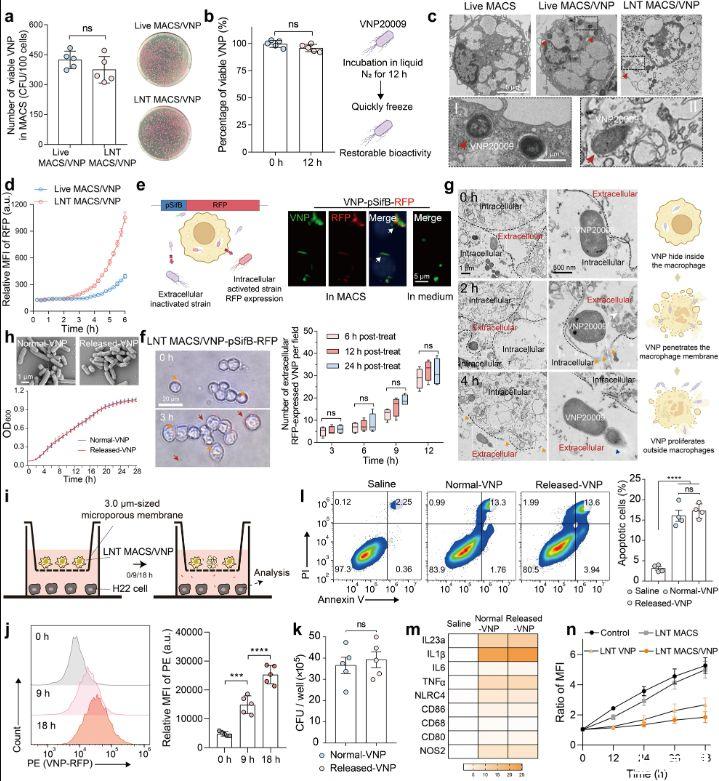
图2、胞内VNP菌株可由LNT MACS/VNP细胞释放并保持其原有的生物活性。a,,活MACS/VNP和LNT MACS/VNP细胞的细胞内活株数量的变化(左)(n=5)。显示了代表性的涂层板(右)。b,液氮冷处理12小时后VNP菌株的存活率(n=5)。冷冻休克处理前后应变活性变化示意图(右)。c,使用透射电子显微镜(TEM)观察不同细胞的形态。红色箭头表示细胞内菌株。比例尺=5μm(正常视野)和1μm(放大视野)。d,实时监测Live MACS/VNP-RFP和LNT MACS/VNP-RFP细胞培养板的RFP荧光强度变化(n=3)。e,使用VNP-pSifB-RFP(红色荧光蛋白,RFP)通过MACS检查细菌释放的示意图(左)。由于pSifB启动子,VNP-pSifB-RFP菌株仅在细胞内被激活并表达RFP。MACS或LB培养基中VNP-psifB-RFP菌株的荧光场图片(右)。激活的VNP-psifB-RFP菌株(红色);沙门氏菌特异性抗体标记VNP(绿色);DAPI标记细胞核(蓝色)。比例尺=5μm。f,从LNT MACS/VNP-pSifB-RFP细胞释放细胞内VNP-pSifB-RFP菌株的明场图片(左)。赫斯特标记细胞核(蓝色)。橙色箭头表示细胞内菌株,红色箭头表示细胞外菌株。将细胞培养在补充有痕量庆大霉素的培养基中。比例尺=20μm。从三个液氮处理时间组(处理后6/12/24小时)的不同时间点随机选择5个视野来计数胞外表达RFP的细菌(右)。g,借助TEM观察LNT MACS/VNP细胞中细胞内VNP菌株的释放(左)。白色曲线显示应变从细胞内到细胞外的运动。橙色箭头表示LNT MACS细胞表面的凹口,这可能是由细胞内应变运动引起的。蓝色箭头表示细胞外增殖的细菌。比例尺=1μm(正常视野)和500 nm(放大视野)。细胞内应变释放示意图(右)。h,正常VNP和LNT MACS释放的VNP在37°C LB液体培养基中的细菌形态(顶部)和生长曲线(底部)(n=3)。i使用3.0μm Transwell小室间接共培养LNT MACS/VNP细胞与H22肿瘤细胞的示意图。细菌可以穿过这种孔径的室。j(i)中H22肿瘤细胞共培养不同时间后的相对平均荧光强度(MFI)比较。k H22细胞以100 MOI的不同VNP感染1小时,并通过将细胞裂解物铺在LB固体板上来确定内化VNP的数量(n=5)。l H22细胞与不同菌株以MOI为100孵育4小时后,对Annexin V和碘化丙啶(PI)染色进行代表性FACS分析,凋亡细胞(Annexin V+细胞)百分比的定量分析显示在右边(n=4)。m不同菌株与M0型巨噬细胞共培养6小时后,通过实时PCR检测抗肿瘤M1型巨噬细胞相关基因的表达水平。n与LNT VNP、LNT MACS或LNT MACS/VNP孵育或不孵育后H22肿瘤细胞的增殖。细胞核染料Hoechst用于检测细胞数量的变化。
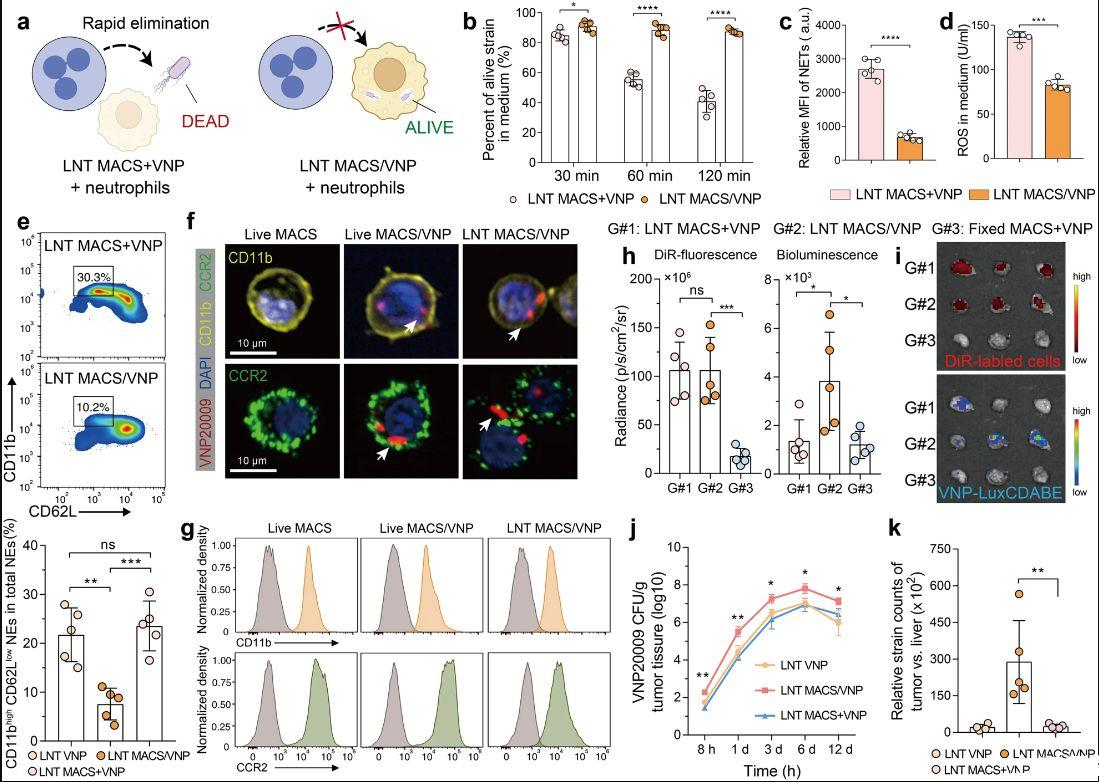
图3、LNT MACS保护VNP菌株免遭清除并促进其在肿瘤中的积累。a LNT MACS/VNP细胞伪装胞内菌株以逃避中性粒细胞介导的细菌清除的示意图。b原代腹膜中性粒细胞与LNT MACS+VNP和LNT MACS/VNP共培养不同时间后培养基中活菌株百分比的变化。c、d比较(b)中不同处理后60分钟培养基中中性粒细胞产生的NET和ROS水平。e不同处理后1小时外周血中性粒细胞总数中活化中性粒细胞(CD11b高CD62L低)百分比变化的代表性流式细胞图(上)和条形比较图(下)(n=5)。f通过共聚焦显微镜分析Live MACS、Live MACS/VNP和LNT MACS/VNP细胞中的CD11b和CCR2表达。白色箭头表示细胞内菌株。比例尺=10μm。g不同细胞中CD11b和CCR2的代表性流式细胞术。h显示指定组肿瘤的荧光和生物发光强度(n=5)。使用DiR标记的细胞和VNP-LuxCDABE菌株。i(h)中不同处理后8小时分离的肿瘤的荧光图像。j注射后时间与肿瘤内细菌数量之间的关系(n=4或5)。k根据第6天提取的器官回收的CFU计算每克细菌CFU的肿瘤与肝脏比率(n=5)
图4、LNT MACS/VNP可降低菌株诱导的生物毒性。a H22荷瘤小鼠不同组别(G0-G4)的安全性评估、肿瘤靶向和治疗试验示意图。b给药1天后各组小鼠肝脏炎症病变的代表性图片。黑色箭头表示病理性肝脏病变的部位。比例尺=10毫米。c(b)中各组肝脏炎症病变点数比较的条形图(n=5)。d代表性H&E染色的特写视图,显示治疗后1天的肝损伤(黑色箭头)。比例尺=40µm。e随机选择(d)中的5个视野来计算病变面积。f不同治疗后1天的血清丙氨酸转氨酶(ALT)和天冬氨酸转氨酶(AST)水平(n=4或5)。g不同治疗后1天体重变化(n=9或18)。h细菌刺激免疫细胞产生炎症因子的示意图。i不同治疗后1天(n=5或6)H22荷瘤小鼠外周血中IL-6(上)和IL-10(下)浓度的检测。j不同治疗后1天外周血CD4+T细胞中Tregs(CD25+CD127 Low细胞)百分比的变化。显示了代表性的流式细胞术图(n=5)。k心脏、肾、肺和脾切片代表性H&E染色的特写视图(比例尺=40µm)。
图5、LNT MACS/VNP细胞有效抑制H22肿瘤生长。a H22荷瘤小鼠不同组别(G0-G4)的安全性评估、肿瘤靶向和治疗试验示意图。b不同治疗后的肿瘤生长情况(n=7)。c(b)中每只小鼠的肿瘤生长曲线。(b)中给药后12天对肿瘤进行拍照(d)并称重(e)。比例尺=10毫米。f(b)中不同组肿瘤体积倍增时间的比较。g肿瘤的代表性H&E染色图像(左),随机选择5个视野来计算坏死区域的面积(右)。黑色箭头表示坏死区域。比例尺=100µm。h按(a)中所述处理的小鼠的存活曲线。当小鼠达到人道终点时,它们被杀死。
总结
本研究开发了一种新型的肿瘤靶向治疗方法,通过冷冻休克巨噬细胞来伪装减毒沙门氏菌,用于癌症的免疫治疗。由于细菌治疗的安全性和有效性难以平衡,限制了其在临床应用的推广。本研究通过液氮冷冻休克处理含有减毒沙门氏菌VNP20009的巨噬细胞株,制备出“死亡”但“功能性”的沙门氏菌加载巨噬细胞。这些处理后的巨噬细胞保持了完整的细胞结构,失去了原有的致病性,而内部的细菌保留了原有的生物活性,并能在体内延迟释放和增殖。这种“特洛伊木马”策略有效避免了细菌免疫原性引起的中性粒细胞招募和激活,减少了细菌被中性粒细胞清除,增强了细菌在肿瘤中的富集效率。Bioscreen全自动生长曲线分析仪用于实时监测不同条件下细菌(如减毒沙门氏菌VNP20009及其变体)在LB培养基中的生长情况,通过Bioscreen C收集的数据,研究者能够比较正常培养条件下的VNP细菌和从冷冻休克巨噬细胞中释放的VNP细菌的生长特性,包括生长速率和生长至稳定期的时间,并确定最佳的细菌培养条件,如温度、pH值和培养基成分,以确保细菌在实验中的稳定性和活性。帮助研究者详细分析了细菌的生长特性,这对于评估冷冻休克巨噬细胞伪装减毒沙门氏菌策略的有效性至关重要。通过这些数据,研究者能够优化治疗方案,并为进一步的体内外研究提供了重要的基础信息。此外这种策略还激活了肿瘤微环境,提高了抗肿瘤效应细胞(包括M1型巨噬细胞和CD8+Teffs)的数量,减少了促肿瘤效应细胞(包括M2型巨噬细胞和CD4+Tregs)的数量,并最终在皮下H22荷瘤小鼠模型中提高了抗肿瘤效果。液氮冷冻休克巨噬细胞介导的细菌输送策略有望扩展活菌治疗癌症的治疗应用。
相关新闻推荐
1、微生物生长曲线分析仪助力嗜麦芽窄食单胞菌组氨酸激酶库的功能图谱绘制(四)
2、结核分枝杆菌通过分泌D-丝氨酸抑制T细胞功能实现免疫逃逸(一)
3、实验证明:非脱羧勒克菌wt16可抑制黄曲霉生长性及产毒(二)
