2结果与讨论
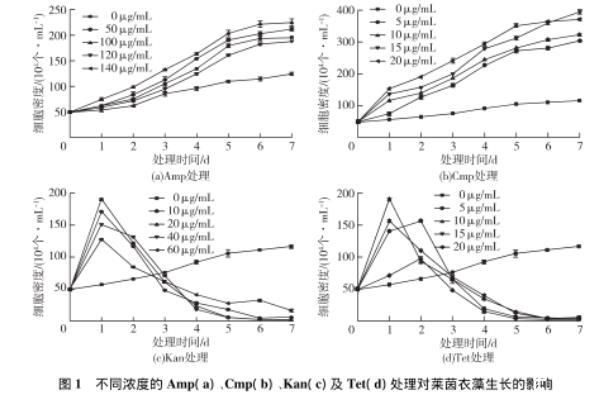
图1不同浓度的Amp(a)、Cmp(b)、Kan(c)及Tet(d)处理对莱茵衣藻生长的影响
目前,用于微藻无菌化处理研究所使用的抗生素种类多样,但针对于不同微藻所使用的抗生素种类及其施加剂量不同,其抑菌的效果也不同。抗生素既可以通过与微藻的某些成分结合,直接作用于藻体,从而改变微藻的生理生化性质,造成微藻生长状态的改变,又可以通过抑制与微藻共生的伴生菌的生长,从而间接影响藻类的生长。本研究根据抗生素在抗菌机制和抗菌谱上的差别,选择了基因工程中常用的4种抗生素Amp、Cmp、Kan及Tet应用于莱茵衣藻的无菌化研究,通过生长曲线、叶绿素a含量、光化学活性等指标并结合4种抗生素的抑菌效果来探究4种抗生素对莱茵衣藻生长及光合作用的影响。
2.1不同抗生素对莱茵衣藻生长的影响
经抗生素处理7 d后,莱茵衣藻生长状况如图1所示。由图1(a)可知:当Amp的处理质量浓度为50及100μg/mL时,对莱茵衣藻的生长有显著的促进作用(P<0.05),其中100μg/mL促进生长的效果高于50μg/mL;当Amp处理质量浓度为120μg/mL时,对莱茵衣藻的生长有轻微的抑制作用;当处理质量浓度达到140μg/mL时,则显著抑制莱茵衣藻的生长(P<0.05)。由图1(b)可知:不同浓度的Cmp处理对莱茵衣藻的生长均有显著促进作用;当Cmp质量浓度为5μg/mL时,就表现出明显的促进作用(P<0.05),浓度越高,促进生长的效应越显著。由图1(c)可知:当Kan的处理质量浓度为10μg/mL时,对莱茵衣藻的抑制作用已达到显著(P<0.05),7 d后,藻液变黄,当Kan的终质量浓度为20μg/mL时,极显著抑制莱茵衣藻的生长(P<0.01),藻液7 d后变透明,镜检结果显示藻细胞内部中空,几乎全部死亡。由图1(d)可知:Tet质量浓度为5μg/mL时,表现出对莱茵衣藻的生长具有显著抑制作用(P<0.05),随着Tet浓度的增加,抑制莱茵衣藻生长的作用更加明显,藻液颜色逐渐变黄并且加深,7 d后镜检结果显示,藻细胞内部中空,几乎全部死亡。
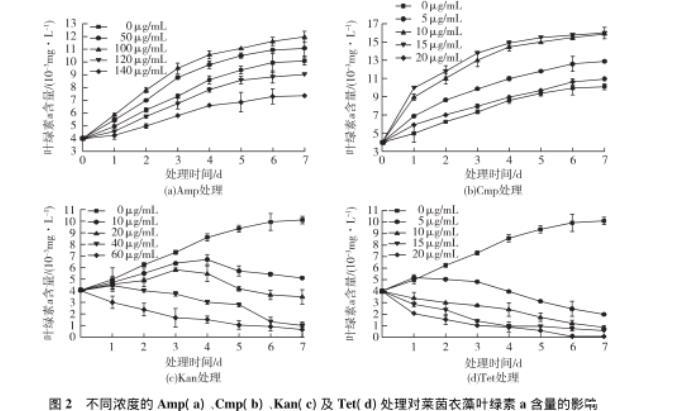
图2不同浓度的Amp(a)、Cmp(b)、Kan(c)及Tet(d)处理对莱茵衣藻叶绿素a含量的影响
不同抗生素对于微藻的毒性效应有所不同,而不同微藻种类对于抗生素的敏感性也有差异。在先前的研究中发现,氨苄青霉素、卡那霉素及链霉素的质量浓度都小于200μg/mL时,对绿色巴夫藻(Pavlovaviridis)的生长有显著促进作用,而在质量浓度分别低于800、500及200μg/mL时,对米氏凯伦藻(Kareniamikimotoi)有促进作用,但如果分别高于此质量浓度,则表现出显著的抑制作用,可见不同藻类对于不同抗生素及不同的质量浓度的响应程度及阈值都存在较大差异。在本研究中,4种抗生素处理对莱茵衣藻的细胞密度存在着较大差异,Amp的低浓度(50和100μg/mL)处理及Cmp各浓度(低于20μg/mL)的处理,促使藻细胞密度增加,表明低浓度的Cmp和Amp基本上对莱茵衣藻细胞无毒性,另外,由于抗生素的加入会杀死藻液中的部分抑生菌,从而促使藻细胞生长的速度加快;Kan及Tet各浓度的处理,都会抑制藻细胞密度的增加,处理的后期会完全杀死藻细胞。对于莱茵衣藻等绿藻来说,诸如Amp等抑制细菌细胞壁合成的β-内酰胺类的抗生素对藻细胞基本无毒性,而诸如Kan、Tet及Cmp等抑制蛋白质合成作用的抗生素对藻细胞具有较高的毒性,但在本研究中,低浓度的Cmp(低于20μg/mL)却没有表现出对莱茵衣藻的毒性,可能是因为抑制蛋白质合成的抗生素主要通过与原核生物线粒体的小亚基结合来抑制其生长及繁殖,在微藻等光合生物中,由于叶绿体在结构上与线粒体相似,这类抗生素可能与叶绿体作用,从而抑制蛋白质合成等代谢过程。而Cmp主要和细菌中的核糖体50S大亚基结合,抑制肽酰转移酶的活性,从而阻止蛋白质的合成,并最终导致细胞死亡,可能是因为Cmp在莱茵衣藻细胞内没有相应的结合位点,从而导致无毒性或者毒性不明显。鉴于原核和真核细胞还存在着本质上的差别,因此抗生素的抑菌作用机制在绿藻等真核细胞内并非和原核生物是直接对应的,其抗生素和微藻之间相互作用的机制还有待进一步研究。
2.2不同抗生素对莱茵衣藻叶绿素a含量的影响
不同种类及浓度的抗生素处理过程中,叶绿素a含量的变化如图2所示。由图2(a)可知:当Amp的处理质量浓度为50及100μg/mL时,莱茵衣藻的叶绿素a含量显著高于未处理组,其中100μg/mL的Amp的处理含量增加得更明显;当藻液中Amp终质量浓度为120及140μg/mL时,莱茵衣藻的叶绿素a的含量低于对照组。由图2(b)可知:不同浓度的Cmp处理都会显著提高莱茵衣藻中叶绿素a的含量,但当质量浓度为20μg/mL时,叶绿素含量低于5μg/mL的处理组,但略高于对照组。由图2(c)可知:各浓度的处理,莱茵衣藻的叶绿素a含量都显著低于对照组,4 d后,叶绿素a的含量开始下降。由图2(d)可知:各浓度的处理使莱茵衣藻的叶绿素a含量都显著低于对照组,1 d后,叶绿素a的含量开始下降。
叶绿素a的含量是用来表征藻细胞生物量变化的另一重要参数。前期研究发现,小球藻(C.vtdgarisBeij.)、金藻8701(IsochrysisgalbanaParke 8701)和小新月菱形藻(NitzschiadosteriumHer.)叶绿素a含量受到氯霉素、遗传霉索、青霉素3种抗生素的影响,其中0~200μg/mL遗传霉素明显抑制3种微藻叶绿素a的含量,质量浓度低于100μg/mL氯霉素对小球藻和金藻叶绿素a含量的影响较小,但当质量浓度大于50μg/mL时,会使小新月菱形藻叶绿素a的含量显著下降;3种藻对青霉素的敏感性存在差异,当质量浓度低于100μg/mL时能够促进3种藻叶绿素a的含量,而相对增长率却随着青霉素浓度的升高而逐渐下降。在本研究中,4种抗生素处理后,叶绿素a含量的变化与藻细胞密度的变化趋势基本上是一致的,即低浓度的Amp(50和100μg/mL)处理及Cmp各浓度的处理,促使藻细胞叶绿素a的含量增加,而Kan及Tet各浓度的处理都会显著减少莱茵衣藻的叶绿素a的含量。低浓度的青霉素处理使藻细胞叶绿素a的含量上升,可能是因为一方面促进细胞内核酸和蛋白质的合成,另一方面降低细胞中叶绿素酶的活性来延缓叶绿素的降解,从而提高叶绿素a的含量;而高浓度抗生素的处理会使藻细胞叶绿素a的含量下降,原因可能是:①抗生素的胁迫可以引起叶绿体膨胀破裂,类囊体膜解体,从而导致叶绿体从组织中流失,抗生素处理的会导致藻体细胞的rETR值下降,也暗示了光合囊体膜遭到了破坏;②细胞内活性氧的积累导致叶绿体结构破坏,叶绿素合成受阻;③抗生素直接与藻体的某些成分结合,抑制叶绿体片层中捕光色素-蛋白复合体的合成,导致转能效率降低。
2.3抗生素对莱茵衣藻光化学活性的影响
2.3.1不同抗生素对莱茵衣藻YII的影响
图3显示了在4种抗生素各浓度的处理下,莱茵衣藻的YII在7 d内的变化情况。图3(a)显示:50μg/mL的Amp处理使莱茵衣藻的YII值在7 d内均高于未处理组;当质量浓度为100μg/mL时,处理后第1天的YII值略高于未处理组,但从第2天开始下降,到第4天明显低于未处理组;当质量浓度为120μg/mL及140μg/mL时,均使莱茵衣藻的YII值在处理后就显著低于未处理组,处理浓度越高,YII值下降越快,其中当质量浓度为140μg/mL时,莱茵衣藻的YII值在7 d后下降为0.36,而未处理组的YII值为0.53。图3(b)显示:5μg/mL的Cmp处理没有显著影响莱茵衣藻的YII值,当质量浓度为10μg/mL时,莱茵衣藻在生长7 d内的YII值略高于未处理组;质量浓度为15μg/mL及20μg/mL的处理均使莱茵衣藻的YII值在处理后显著低于未处理组,处理浓度越高,YII值下降得越快,其中当质量浓度为20μg/mL时,莱茵衣藻的YII值在7 d后下降为0.30,而未处理组的YII值为0.53。图3(c)及图3(d)显示:各浓度的处理均使莱茵衣藻的YII值在处理后就显著低于未处理组,并且处理浓度越高,YII值下降得越快,其中质量浓度40μg/mL的Kan及20μg/mL的Tet在处理后的第1天就使莱茵衣藻的YII值从未处理时的0.47下降到0.001。

图3不同浓度的Amp(a)、Cmp(b)、Kan(c)及Tet(d)处理对莱茵衣藻YII的影响
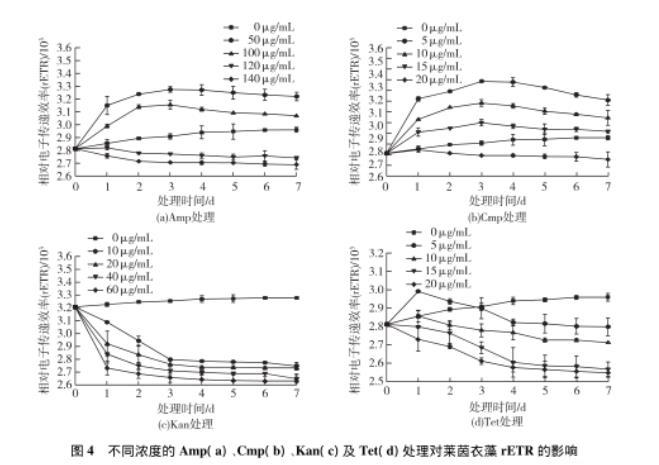
图4不同浓度的Amp(a)、Cmp(b)、Kan(c)及Tet(d)处理对莱茵衣藻rETR的影响
2.3.2不同抗生素对莱茵衣藻rETR值的影响
图4显示了在4种抗生素各浓度的处理下,莱茵衣藻的rETR值在7 d内的变化情况。图4(a)显示了质量浓度为50及100μg/mL的Amp处理使莱茵衣藻的rETR值均高于未处理组,且50μg/mL处理的rETR值高于100μg/mL处理的rETR;当Amp质量浓度为120及140μg/mL时,从处理后第2天开始,rERT值显著低于未处理组。图4(b)显示:Cmp处理时,除20μg/mL质量浓度外,其他3个处理浓度的rETR值均高于未处理组,且5μg/mL处理的rETR值大于10μg/mL处理的rETR值,10μg/mL处理的rETR值大于15μg/mL处理的rETR值。图4(c)显示:Kan各浓度处理的rETR值均小于未处理组,且处理的浓度越高,rETR值下降得越低。图4(d)显示:Tet的处理在质量浓度为5μg/mL时,第1天的值升高,随后下降,到第3天时与未处理组相同,随后下降显著低于未处理组,其他3个处理浓度均低于未处理组。
叶绿素荧光的变化能够真实地反映光能吸收、激发光能传递和光化学反应等光合作用的原初反应过程。YII及rETR分别指光系统II的实际光能转换效率或实际光量子产额及经过光系统II的相对线性电子流。在本研究中,莱茵衣藻的YII及rETR对抗生素的处理非常敏感。YII的值在低质量浓度的Amp(50μg/mL)及Cmp(10μg/mL)处理的前期(3 d前)升高,可能与藻液中抑生菌的去除有关,但在3 d后,YII的值有所下降,说明低浓度的Amp及Cmp的处理会对YII有轻微的抑制作用;对于Kan及Tet的处理,在加入抗生素后YII就急剧下降,说明Kan及Tet的处理会严重抑制莱茵衣藻的光反应,也有报道证明,链霉素会选择性地给合小球藻的核糖体70S亚基,从而抑制小球藻的PSII的D1、CP43及CP47等蛋白的合成,来降低小球藻的光合效率;rETR值在低质量浓度的Amp(50及100μg/mL)及Cmp(5、10及15μg/mL)处理的rETR值都高于未处理组,但随着处理时间的延长,rETR值逐渐降低;Kan及Tet的处理都会使rETR的值急剧下降;rETR值随着抗生素的加入下降,rETR值的大小反映了PSII反应中心在光下的开放程度,它的降低暗示了光反应中心的关闭,可能是由于抗生素的存在阻碍了光合电子传递过程中的由电子传递体QA到QB的电子传递过程,也可能是抗生素作用于电子传递链上的蛋白酶,抑制酶的活性,进而影响电子传递,从而影响光合作用效率。本研究结果可以看出,4种抗生素的处理对YII与rETR值的影响具有很强的相关性,但影响的程度有些不同,光合效率降低的部分原因是由于电子传递效率的下降,除此之外可能还包括热能散失及非光化学淬灭等因素。关于抗生素对光化学活性的影响机制,目前仍然没有确切的解释,其机制有待进一步揭示。
2.4抗生素对莱茵衣藻伴生细菌的抑制作用
将抗生素处理7 d后和对照组的藻液用无菌TAP培养液稀释100倍,分别涂布在LB培养基上,菌落生长情况如图5所示,结合图5细菌数量的统计结果,表明在笔者所选取的浓度内,随着4种抗生素浓度的增加,细菌的数量随之减少,浓度越高效果越明显。当藻液中Cmp的终质量浓度达到20μg/mL时,可以完全抑制藻液中细菌的生长。在20μg/mL质量浓度下,虽然Tet对藻液中细菌的抑制作用也很明显,但由于Tet质量浓度为5μg/mL时,就已经表现出对莱茵衣藻的生长具有显著抑制作用(P<0.05);藻液中Kan的终质量浓度达到60μg/mL时,即使可以完全抑制细菌的生长,但其质量浓度为10μg/mL时,对莱茵衣藻的抑制作用已达到显著(P<0.05);另外,当藻液中Amp的终质量浓度140μg/mL时,并没有完全抑制藻液中细菌的生长,仍可以观察到有少数细菌菌落长出。因此,Amp、Tet及Kan不适合应用于莱茵衣藻的无菌化中。
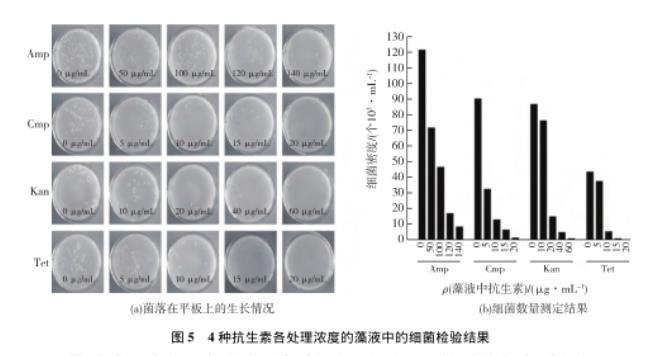
图5 4种抗生素各处理浓度的藻液中的细菌检验结果
3结论
4种抗生素Amp、Cmp、Kan及Tet的不同浓度对莱茵衣藻的细胞密度、叶绿素a含量及光化学活性都产生显著的影响。Amp(低于100μg/mL)及Cmp(低于20μg/mL),对莱茵衣藻的生长有显著的促进作用,而Kan及Tet的各处理浓度都会显著抑制莱茵衣藻的生长;莱茵衣藻的光化学活性对4种抗生素的处理比较敏感,虽然在处理的3 d内,Amp(低于50μg/mL)及Cmp(低于10μg/mL)由于“毒物效应”会增加莱茵衣藻的YII及rETR值,但处理后期是呈现下降趋势的,因此4种抗生素的长期存在都会使莱茵衣藻的PSII反应中心受损,光合电子传递过程受阻及光合效率降低。此外,低浓度的Cmp可用于莱茵衣藻细胞无菌化培养中,而Amp、Kan及Tet则不适合用于莱茵衣藻的无菌化培养。本研究结果表明,水生环境中抗生素的存在,会显著影响莱茵衣藻的生长及光化学活性,尤其是不断累积的抗生素也会对莱茵衣藻等微藻的生态平衡产生影响。
相关新闻推荐
1、Biosense微生物生长动态监测系统优化哈茨木霉菌生长条件研究方案
2、小儿咽拭子肺炎支原体(MP)的鉴定培养和药物敏感试验结果
3、基于革兰氏阳性菌生长曲线等指标评价纤维素基抑菌材料L-Met改性MCC(M-MCC)抑菌效果(四)
