果胶杆菌(P.carotovorumsubsp.carotovorum)是一种危害广泛的植物病原菌,能够侵染白菜类蔬菜、马铃薯、胡萝卜、洋葱、辣椒、大蒜、人参、君子兰、魔芋、郁金香、马蹄莲等植物,破坏力强,危害较大。目前,国内外对果胶杆菌的致病机理以及抑制方法研究较少。二氧化氯是国际上公认的最新一代的高效、广谱、安全的杀菌剂和保鲜剂,具有适应面广、使用剂量低、效果好、反应快、无毒、无副作用等优点,但是二氧化氯对果胶杆菌的抑制研究鲜有报道。
果胶酶系和纤维素酶系在植物病原菌侵染的过程中起着关键作用,可以破坏植物的细胞壁结构,分解利用植物细胞和组织内营养成分,引起细胞死亡。本试验采用二氧化氯处理果胶杆菌,研究二氧化氯溶液对果胶杆菌活力以及致病相关酶活性的影响。
1材料与方法
1.1材料
1.1.1试验材料
果胶杆菌(P.carotovorumsubsp.carotovorum)由自然发病的杭白菜软腐病病斑上筛选分离得到,纯化后于4℃保存,备用。
1.1.2试验仪器
分光光度计(752紫外可见分光光度计)、超净工作台、高压灭菌锅、恒温培养箱、全自动微生物曲线分析仪、恒温水浴锅、电子天平等。
1.1.3培养基配方
二氧化氯(食品级)及其他试剂(分析纯)在国药化学试剂有限公司购买。
LB液体培养基:胰蛋白胨10g,酵母提取物5g,氯化钠10g,用蒸馏水定容至1 000mL,灭菌后备用。
LB固体培养基:依照LB液体培养基,每1.0 L再加入15g琼脂,灭菌后备用。
细胞壁降解酶诱导培养基:参照Marcus L等的方法。
1.2试验方法
1.2.1试剂的配制以及标准曲线的制作
(2)取二氧化氯母液和无菌水分别配制浓度为1.01 mgL、4.03 mgL、7.02mgmL的二氧化氯溶液,备用。
还原糖标准曲线的制作:按照表1,分别将试剂加好后摇匀,冷却至室温后定容至25 mL,540nm下测定波长。
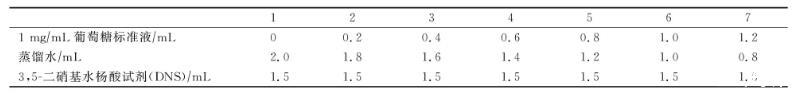
表1还原糖标准曲线的制作
半乳糖醛酸标准曲线的制作方法与还原糖标准曲线制作方法相同。
1.2.2二氧化氯溶液对果胶杆菌的处理方法
1.2.2.1果胶杆菌生长曲线的测定
将50个锥形瓶装的LB液体培养基平均分为五组,编码为A、B、C、D、E组(每组10个平行),分别加入100μL菌悬液,其中A、B、C、D和E五个处理组再分别加入0 mL、1.28 mL、2.63 mL、4.05 mL和5.56 mL的二氧化氯母液,于25℃下振荡培养,2h后取出各组的1号锥形瓶即A1、B1、C1、D1、E1放置于4℃冰箱,随后每隔2h按各组编号从小到大依次取出锥形瓶并放入冰箱,待培养20 h后测定OD值。
1.2.2.2果胶杆菌存活率的测定
将1.2.2.1中培养20 h后的菌悬液分别稀释至原浓度的10-1、10-2、10-3、10-4,吸取10-3、10-4菌悬液100.0μL,涂布平板,静置10min后于恒温培养箱25℃培养36 h,记录平板上的细菌总数,按照公式(1)计算细菌存活率。
存活率=处理组细菌总数/对照组细菌总数*100%(1)
1.2.2.3果胶杆菌细胞膜透性的测定
取培养3d的菌液10mL在4℃下离心,弃去上清液后,用吸水纸吸取菌体表面的水分,各取1g,离心后菌体放入含有0.25mgL、0.5mgL、0.75mgL、1.0mgL四种浓度二氧化氯的锥形瓶中,用电导仪测定溶液电导率记,为C0,然后在100 rmin、25℃震荡培养,分别在0 min、30 min、60 min、90 min、120 min、150 min测定菌体浸出液的电导率,记为Ct。测完后,将所有三角瓶放置于沸水中煮沸15 min,以杀死菌体细胞,待冷却至25℃后再次测定各电导率值,记为C。根据公式(2)计算相对电导率值(%),用相对电导率表示菌体细胞膜的通透性。试验重复3次,每个处理设5个平行。
相对电导率=(Ct-Co)/C*100%(2)
式中:C0-0min时测定的的电导率值;Ct-各时间测定的电导率值;C-煮沸后测定的电导率值。
1.2.2.4细胞壁降解酶活力的测定
(1)果胶酶(PG)活力测定
取0.5%果胶1.9mL,50℃的条件下预热10min,加0.1mL酶液,50℃条件下反应30min,加入1.5mL DNS(3,5-二硝基水杨酸,3,5-Dinitrosalicylic acid),沸水浴5min,定容至25mL,测定540nm下波长。
(2)聚甲基半乳糖醛酸酶(PMG)活力测定
取1%果胶1.5mL,30℃的条件下水浴30 min,加入0.5 mL酶液,在30℃的条件下反应30 min,加入1.5 mL DNS,沸水浴5 min,定容至25 mL,测定540 nm下波长。
(3)甲基纤维素酶(CX)活力的测定
取0.51%羧甲基纤维素(CMC)溶液1.5mL,50℃预热10min后,加入0.5mL酶液,50℃的条件下,反应30min,加入1.5mL DNS,沸水浴5min,定容至25mL,测定540nm下波长。
(4)β-葡萄糖苷酶(GLU)活力测定
1.2.2.5果胶杆菌致病力的测定
取杭白菜叶柄基部切4 cm左右的茎段,75%酒精擦拭消毒,下衬一张无菌滤纸,置于无菌培养皿中,并加入2.0 mL无菌蒸馏水保持湿度。用灭菌小刀在其中心划2 mm×2 mm的十字型伤口,深度为1.5 mm左右,取10μL的经不同浓度二氧化氯气体处理、浓度为105个mL果胶杆菌菌悬液加入十字形伤口处,重复5次。用封口膜将培养皿封口于25℃培养。每隔3 h观察其发病情况,测量病斑长度,每组20个平行处理,并按公式(3)计算发病率。
发病率=调查发病茎段数/调查茎段总数*100% (3)
相关新闻推荐
2、新疆石河子驴源马链球菌不同培养条件下的生长曲线及消毒剂敏感性研究(二)
