2结果与分析
2.1酒曲中产凝乳酶优势菌株的确定
2.1.1菌株初筛
利用倍比稀释法从发酵的江米酒中分离纯化得到13株不同菌落形态的纯种菌株,将分离纯化得到的13株不同菌株分别以三点法点接于酪蛋白平板上,置于30℃恒温培养箱内培养2 d,观察并测定菌株所产凝乳圈及水解圈直径(表1)。
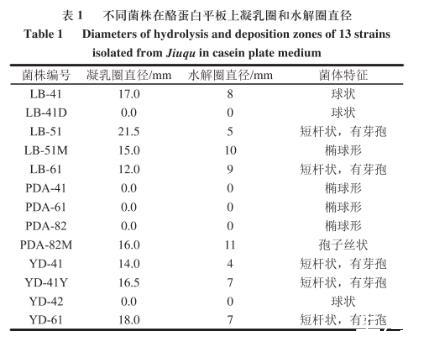
表1不同菌株在酪蛋白平板上凝乳圈和水解圈直径
从表1可以看出,LB-41D、PDA-41、PDA-61、PDA-82和yD-42这5株菌所产凝乳圈和水解圈直径为0,表明这5株菌不产生凝乳酶。其余8株菌在酪蛋白平板上都有不同大小的凝乳圈和水解圈。白色凝乳圈大说明菌株产凝乳酶的凝乳活力高,水解圈大说明菌株产凝乳酶蛋白水解活力高。菌株所产凝乳酶蛋白水解活力的大小对干酪质构和特殊风味有着重要的影响,蛋白水解活力高使干酪中蛋白水解过度生成苦味肽而导致制作的干酪有苦味,使消费者难以接受。所以在筛选过程中应选取凝乳活力高而蛋白水解活力低的菌株。从有不同大小凝乳圈和水解圈的8株不同菌株来看,其中LB-51菌株所产凝乳圈直径最大同时水解圈直径较小,由此可以初步选择LB-51菌株为产凝乳酶优势菌。
2.1.2菌株的复筛
将有白色凝乳圈的8株菌分别接种于LB、yPD和PDA液体培养基中,在30℃、120 r/min条件下恒温振荡培养24 h,测定凝乳和蛋白水解活力,结果如表2所示。
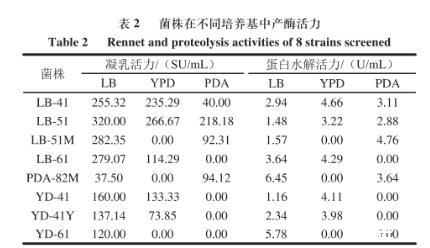
表2菌株在不同培养基中产酶活力
由表2可知,菌株在LB中产凝乳酶的凝乳活力相对较高,在液体PDA培养基中产凝乳酶的凝乳活力最低。其中LB-51菌株在LB中发酵24 h时产凝乳酶的凝乳活力可达320 SU/mL,在8株菌中产凝乳酶的凝乳活力最高,同时LB-51菌株在LB中发酵时蛋白水解活力相对较低。所以确定LB-51菌株是酒曲中产凝乳酶的优势菌。对于8株菌株选择了3种不同的液体发酵培养基,只有在LB中产凝乳酶的凝乳活力较为理想;部分菌株在yPD和PDA中产酶活力不高或不产凝乳酶,这与培养基中营养成分和比例有关,说明这2种培养基营养成分和比例不适合菌株产凝乳酶。所以3种液体培养基中选择LB作为基础培养基,可通过优化其营养成分和比例来进一步提高菌株的产凝乳酶的凝乳活力。
2.2菌株初步鉴定
2.2.1形态学观察
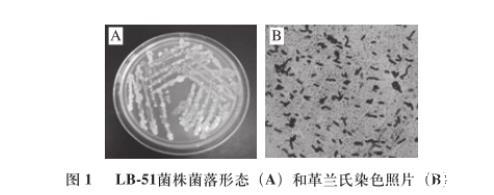
图1 LB-51菌株菌落形态(A)和革兰氏染色照片(B)
将菌株LB-51在LB固体平板上划线培养48 h后,其菌落为乳白色稍显微黄,菌落边缘不整齐,表面粗糙有黏液,不透明。通过革兰氏染色、芽孢染色和穿刺培养实验,菌株LB-51为革兰氏反应为阳性,短杆状,具有运动性,有芽孢,芽孢中生。
2.2.2 API生化试剂条法
将API生化试剂条法对菌株LB-51的发酵结果(表3)提交ApiWeb软件中进行比对鉴定,结果可初步判定菌株LB-51为解淀粉芽孢杆菌(Bacillus amyloliquefaciens)或地衣芽孢杆菌(B.licheniformis)。
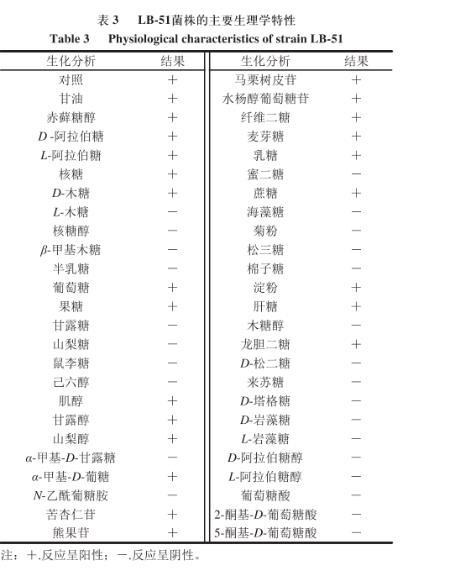
表3 LB-51菌株的主要生理学特性
2.2.3菌株16S rDNA序列扩增结果
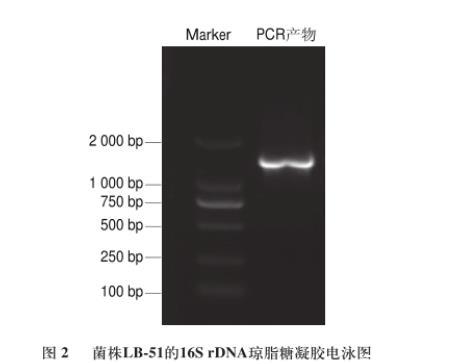
图2菌株LB-51的16S rDNA琼脂糖凝胶电泳图
以菌株LB-51基因组DNA为模板,经PCR扩增后产物进行1%琼脂糖凝胶电泳,结果在约1 500 bp处有一条特异性条带,结果见图2。将PCR产物回收纯化后进行测序,结果菌株LB-51的16S rDNA序列长度为1 450 bp。
2.2.4基于16S rDNA序列同源性比对与系统发育分析
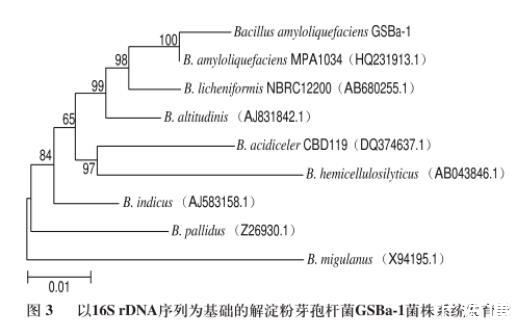
图3以16S rDNA序列为基础的解淀粉芽孢杆菌GSBa-1菌株系统发育树
将菌株LB-51的16S rDNA基因序列与在GenBank中序列大小相近的已知菌株的相应序列进行比对,然后选取与LB-51序列同源性较高的菌株序列,利用MEGA6.0软件进行分析,构建系统发育进化树。结果如图3所示,菌株LB-51与解淀粉芽孢杆菌MPA1034(HQ231913.1)在同一分支上,并通过MEGA 6.0软件中Bootstrap的验证表明它们具有较高的置信度,且支持率可达100%。结合上述形态学、生理生化实验结果可将菌株LB-51确定为解淀粉芽孢杆菌,并进一步将此产凝乳酶菌株命名为解淀粉芽孢杆菌GSBa-1。
相关新闻推荐
1、杉木心材提取物对木腐菌(白腐菌和褐腐菌)抑制性能分析(二)
