Act0988菌株产对柑橘青霉等多种霉菌具抗菌活性的代谢产物,对菌株进行鉴定、研究培养条件与菌株生长的关系,以为后续开发菌株产抗菌物质的培养基筛选及发酵工艺技术的研究奠定基础。以菌株的形态、培养特征、生理生化特征及16S rDNA序列分析进行菌种鉴定,三角瓶液体振荡培养研究碳氮源、温度、pH及氧与菌株生长的关系。结果表明,Act0988菌株为多产色链霉菌(Streptomyces polychromogenes),菌株生长最佳碳源为可溶性淀粉,发酵液生物量5.8 mg/mL;酵母膏与蛋白胨为最佳氮源,生物量5.7 mg/mL左右。菌株最适温度28℃,生物量6.0 mg/mL。最适初始pH7.0,生物量6.2 mg/mL;最适装液量60 mL/500 mL,生物量6.3 mg/mL。Act0988菌株易培养,发酵液抗菌活性强,菌株产抗菌物质具有突出的开发利用潜力。
在我国,每年果蔬采后腐烂约8 000万t,经济损失约750亿元,占果蔬产业总值的30%以上[1]。采收贮运中的机械损伤是病原菌侵入的主要途径,也是采后果实腐烂的重要因素。目前控制果蔬采后腐烂的有效方法仍是化学杀菌剂与冷藏结合的处理,化学杀菌剂长期大量使用既使病菌产生抗药性,还因残留影响食用安全以及废弃药液造成环境污染。寻求安全有效、生态友好的果蔬采后防腐剂替代化学杀菌剂早已受世人的高度关注。生物防腐具有无毒、无残留等优点,被公认为是果蔬采后无公害防腐的有效途径[2]。许多学者就活体拮抗微生物用于水果采后防腐进行大量的实验研究,分离筛选了多种对采后苹果、柑桔、梨等具防腐效果的拮抗菌株[3]。也有以微生物代谢产物用于采后果蔬防腐保鲜的报道,如李振华等[4]从土壤筛选的6株链霉菌发酵液对香蕉炭疽病菌有良好的抑菌作用,申光辉等[5]以黄暗色链霉菌发酵液进行草莓的防腐保鲜等。
Act0988是从自然界采样分离、筛选获得的放线菌拮抗菌株,菌株产抗菌物质对采后柑桔、荔枝、龙眼等果实上分离的青霉、曲霉、交链孢菌等多种引起水果腐烂的霉菌具很强的抗菌活性,抗菌物质有350 nm、332 nm及317 nm三个紫外吸收峰,光谱特征与多烯大环内酯类广谱抗真菌抗生素光谱特征基本吻合[6,7],推断为一种多烯大环内酯类抗生素。多烯大环内酯类抗生素是世界公认安全、广谱、高效的抗真菌抗生素,国内外近年已用于加工食品的防腐,亦有用于防治农作物病害的报道[6,8-10],而且多烯大环内酯类抗生素临床使用半个多世纪几乎未出现抗药性[11]。开发Act0988菌株产抗菌物质用于水果采后防腐将具有重要的经济、社会与生态效益。本研究拟针对Act0988菌株的鉴定、培养条件与菌株生长关系进行研究,旨为后续开发菌株产抗菌物质的培养基筛选及发酵工艺技术研究奠定基础。
1材料与方法
1.1材料
1.1.1菌种来源以粤东北地区采土样,经分离、筛选获得。
1.1.2指示菌拮抗菌株的筛选及Act0988拮抗菌株发酵液抗菌活性测定以青霉菌(Penicillium italicum)为指示菌,菌种由嘉应学院生命科学学院实验室提供。
1.2方法
1.2.1 Act0988拮抗菌株的分离、筛选无菌水浸泡、搅拌,静置稀释,稀释液涂布高氏一号平板,28℃培养7 d。挑外围有霉菌透明抑菌圈的单菌落纯化,28℃培养3 d,挑单菌落于高氏一号斜面培养。纯培养物与青霉菌在PDA平板上对峙接种,28℃培养4 d观察抑菌效果。经多次采样、分离筛选获得抑菌效果最佳的纯培养为供试菌株,编号:Act0988。
1.2.2菌株发酵液的抗菌活性发酵培养基含玉米淀粉40 g/L、豆饼粉30 g/L、酵母膏1 g/L。玉米淀粉与0.5%α-淀粉酶混合,加适量蒸馏水调为糊状,80℃处理30 min,蒸馏水补足1 000 mL,调pH=8.0,取100 mL装入500 mL三角瓶,8层纱布封口,121℃蒸汽灭菌20 min,备用。斜面菌种接于发酵培养基,28℃、200 r/min发酵6 d,发酵液6000 r/min离心30 min,收集上清液备用。取1 mL青霉菌孢子悬浮液(108个孢子/mL)加入90 mm培养皿,倒入PDA培养基20 mL混匀,冷凝后在平板叠放6 mm无菌滤纸片2张,取发酵液的离心上清液20μL滴加于滤纸片上,28℃培养72 h,测量抑菌圈直径。
1.2.3菌株产抗菌物质的吸收光谱菌株发酵液经10 000 r/min离心20 min,沉淀加2倍体积无水甲醇充分混匀、浸泡,离心,上清液冷冻干燥得粉末粗提物。粗提物再以无水甲醇溶解、离心,上清液冷冻干燥,样品再以沃特世1525半制备/分析HPLC纯化,收集350 nm主峰洗脱液,冻干后以无水甲醇溶解,无水甲醇做基线,在190-1 100 nm内进行光谱扫描得菌株产抗菌物质的吸收光谱。
1.2.4菌株的菌落与形态特征菌种接于相应培养基的新鲜平板,28℃培养7-14 d,观察菌落特征。菌种接种于新鲜的高氏一号平板,将盖玻片斜插入平板,28℃培养5 d[12],观察菌丝和孢子形态特征。
1.2.5菌株生理生化明胶液化、甲基红实验、硝酸盐还原等生理生化实验培养基参照《植物研究方法》[12]制备。菌种接种于相应培养基,28℃培养培养7 d观察菌株的生理生化特性。
1.2.6菌株的鉴定菌株于高氏一号液体培养基28℃、150 r/min培养5 d、提取细胞DNA。以引物A:5'-AGAGTTTGATCCTGGCTCAG-3',引物B:5'-AAGGAGGTGATCCAGCCGCA-3'[13],进行菌株16S rDNA的PCR扩增,扩增产物进行碱基测序,16S rDNA碱基序列与GenBank核酸序列数据库进行同源性对比。根据16S rDNA同源性对比结果及菌株的形态、生理生化特性,参考《放线菌的分类与鉴定》[14]中方法鉴定菌株的属、种名。
1.2.7碳源、氮源与菌株生长的关系以可溶性淀粉20 g/L、蛋白胨10 g/L及酵母膏1 g/L(pH=8)为基础培养基,100 mL培养基装入500 mL三角瓶,8层纱布封口、灭菌备用。斜面菌种接入基础培养基,28℃、200 r/min培养48 h为种子液。以供试碳源20 g/L替换基础培养基中的可溶性淀粉,以供试含氮生化试剂、氮盐10 g/L替换基础培养基内的蛋白胨,制备不同碳、氮源培养基,100 mL培养基装入500 mL三角瓶,灭菌备用。每瓶培养基内接种子液5 mL,28℃、200 r/min培养96 h,3次重复。取30 mL发酵液6 000 r/min离心30 min,沉淀加蒸馏水20 mL混匀、离心,沉淀100℃烘箱过液,称菌丝体干重,按如下公式计算发酵液的生物量:
生物量=菌丝体干重/发酵液体积
1.2.8温度、pH及装液量与菌株生长的关系种子液5 mL接于装100 mL基础培养基三角瓶内,分别于设定温度下200 r/min培养96 h,同上测定生物量,研究温度与菌株生长的关系。种子液5 mL接于装不同pH值基础培养基100 mL的三角瓶内,28℃、200 r/min培养96 h,同上测定生物量,研究培养基初始pH与菌株生长的关系。5 mL种子液接于装有不同体积基础培养基的三角瓶内,28℃、200 r/min培养96 h,取10 mL发酵液测定发酵液生物量,研究装液量与菌株生长的关系。
2结果
2.1菌株发酵液对柑橘绿霉菌的抗菌活性
Act0988菌株发酵液离心上清液20μL滴于混有青霉孢子的PDA平板的滤纸片上,28℃培养72 h透明抑菌圈直径(18.4±0.8)mm,抑菌圈清晰、透明(图1)。发酵液平板抑菌实验表明,发酵液对青霉菌抗菌活性强、持效期长,Act0988野生型菌株发酵产抗菌物质的生产能力较大。
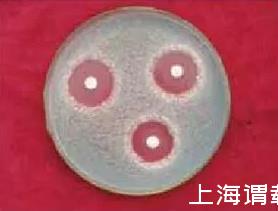
图1菌株发酵液对指示菌的PDA平板抗菌活性
2.2菌株抗菌物质的吸收光谱
Act0988菌株产抗菌物质样品甲醇溶液经紫外—可见光谱扫描的紫外吸收光谱(图2)显示,菌株产抗菌物质分别在351、333及318 nm有3个吸收峰,光谱特征与多烯大环内酯类的纳他霉素及金褐霉素的光谱特征基本吻合,结果初步表明菌株产抗菌物质属广谱抗真菌的多烯大环内酯类的1种抗生素。
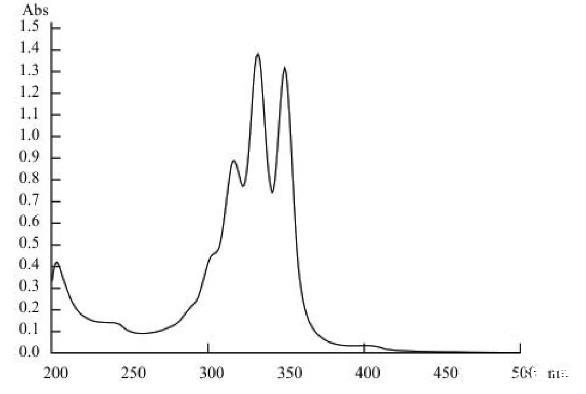
图2菌株产抗菌物质的吸收光谱
2.3菌株的形态、菌落特征
2.3.1菌株的形态菌株在高氏一号平板插片培养5 d,显微镜观察,菌株孢子丝单生、直形或松散螺旋,孢子椭圆形、柱形,表面光滑(图3,图4)。
2.3.2菌株的菌落特征菌株在麦芽精酵母精琼脂(ISP2)、燕麦粉琼脂(ISP3)、无机盐淀粉琼脂(ISP4)、甘油天冬素琼脂(ISP5)等培养基上培养14 d的菌落特征,见表1。
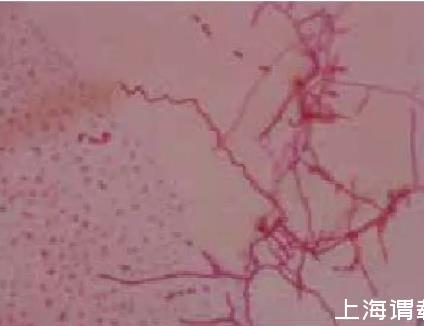
图3菌株螺旋孢子丝

图4菌株柱状孢子

表1菌株在7种培养基上的菌落特征
2.4 Act0988菌株的生理生化
Act0988菌株的生理生化特性及碳源利用测定结果,见表2。

表2 Act0988菌株的生理生化特性
2.5 Act0988菌株的鉴定结果
Act0988菌株16S rDNA序列经PCR扩增,产物为1 391 bp,碱基序列与GenBank中的序列进行同源检索比对,结果表明,Act0988菌株碱基序列与多产色链霉菌[Streptomyces polychromogenes(NR 0411-09.1)]同源性为100%。Act0988菌株的生物学特性与《放线菌的分类与鉴定》描述的多产色链霉菌基本一致,故将Act0988菌株鉴定为多产色链霉菌(Streptomyces polychromogenes),系统发育树见图5。
2.6碳、氮源与菌株生长的关系
2.6.1碳源Act0988菌株供试的9种碳源都能生长,但生物量差异较大。其中,可溶性淀粉培养基的生物量最大,为5.8 mg/mL,与其它碳源培养基生物量的显著差异;其次是蔗糖和乳糖,发酵液生物量分别为5.1 mg/mL和5.0 mg/mL,两者间差异不显著;菌株在葡萄糖、麦芽糖、丙三醇碳源培养基中生长均较差(图6)。

图5 Act0988菌株16S rDNA系统发育树
2.6.2氮源供试氮源与Act0988菌株生长的关系(图7)表明,菌株对所有供试氮源都能利用,在以酵母膏与蛋白胨为氮源的培养基中的生物量最大,为5.7 mg/mL左右,两者差异不显著(P<0.05);牛肉膏培养基的生物量为4.9 mg/mL,尿素培养基的生物量为4.1 mg/mL。菌株以KNO3、NH4NO3或NaNO3为氮源的生物量显著低于有机氮源,(NH4)2SO4氮源培养的生物量最低。结果表明,供试生化试剂类有机氮源最利于菌株生长。
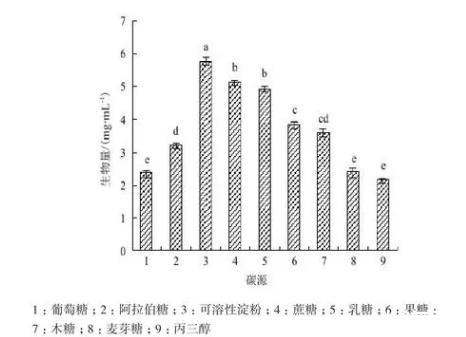
图6碳源与菌株生长的关系
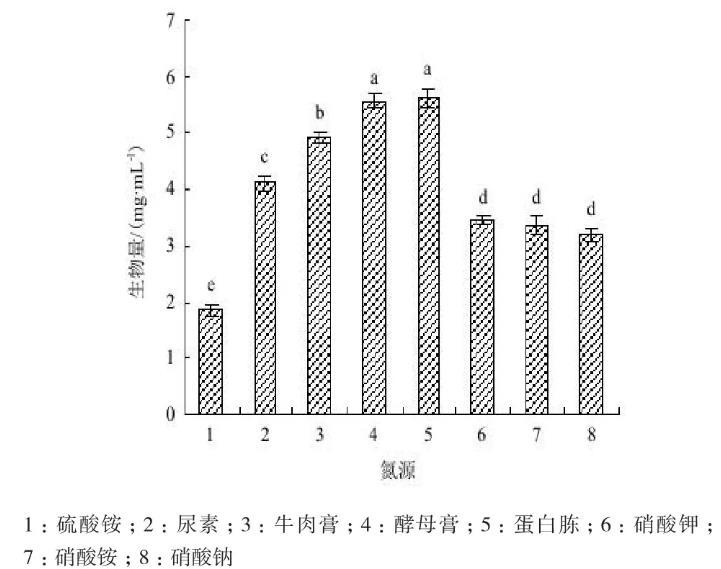
图7氮源与菌株生长的关系
Act0988放线菌拮抗菌株的鉴定、培养条件与菌株生长关系、发酵工艺(一)
Act0988放线菌拮抗菌株的鉴定、培养条件与菌株生长关系、发酵工艺(二)
相关新闻推荐
1、基于低生物量微生物富集方法观察ICU患者下呼吸道微生物组的功能和进化动态
3、微生物的分离培养方法、操作步骤及注意事项——划线分离法、涂布平板法
