目前,鱼类细胞作为研究工具颇受关注,已经被应用到鱼类肿瘤学、环境毒理学、遗传学、内分泌学、生理学和资源保护等方面。与体内实验相比较,鱼类细胞培养具有一定优势:细胞培养产品标准化程度高、均一性好;鱼类离体培养细胞尤其是原代培养细胞,其生理生化功能接近在体状态,能够快速获得实验结果;而且可根据鱼类生长阶段,进行不同时期影响研究;可重复性高,离体条件下可以更为精确控制实验条件,有针对性地开展研究。因此,本研究成功进行了草鱼脑细胞的原代培养,为进一步开展体外生理调控机制研究提供基础。
实验动物
草鱼购于湖北仙桃排湖渔场,暂养于实验室循环水系统,选取健康且体表无损伤的个体,平均体重(187.50±8.42)g。
实验试剂
L-15液体培养基、胰蛋白酶均为Gibco公司产品;胎牛血清(FBS)为Hyclone公司产品;CellTiter 96®AQueous One Solution Cell Proliferation Assay为Promega公司产品。青霉素、链霉素、两性霉素分别配制成母液,经0.22μm滤过除菌,分装,-20℃保存。PBS缓冲液:0.01M Na2HPO4、0.01M NaH2PO4、0.15M NaCl,pH 7.2,高压灭菌,4℃保存。4.0%台盼蓝母液,用滤纸过滤,4℃保存,使用时用PBS将其浓度稀释至0.4%。
细胞原代培养
实验草鱼冰上麻醉,剪断鳃部脉弓,放血约10 min,70%乙醇体表消毒。在无菌条件下,解剖取脑,以含有抗生素500 IU/mL青霉素和500μg/mL链霉素及2.5μg/mL两性霉素的PBS缓冲液冲洗3次。分别采用不同方法尝试进行原代培养:1)组织块培养法,用眼科剪将组织剪碎成约1~2 mm3的小块。用完全培养基(10%FBS,青霉素100 U/mL、链霉素100μg/mL、两性霉素2.5μg/mL)浸润培养瓶,将组织块转移到培养瓶中,均匀排列,加入1 mL完全培养基,于28℃CO2培养箱(SANYO,MCO-18AIC)中培养。在培养的1~2 d内避免移动培养瓶,以便组织块贴壁,在2~3 d吸出培养基,添加3 mL新鲜培养基继续培养。2)消化法,用眼科剪将组织切成2~3 mm3小块,以便于消化。0.25%胰蛋白酶酶解处理,期间轻轻摇动数次。消化液混浊则吸出少许消化液于显微镜镜检,若组织已分散成单个细胞或细胞团即终止消化。通过30μm不锈钢筛,滤掉尚未充分消化开的组织块。600 rpm低速离心10 min收集细胞,完全培养基再悬浮,于28℃培养箱中培养。3)机械破碎法,在完全培养基浸润的细胞培养皿中,将脑组织置于200目灭菌尼龙网上,采用无菌注射器的橡胶推头轻轻挤压使脑组织通过网孔,得到细胞悬液,收集细胞悬液后通过100目的尼龙网过滤,600 rpm低速离心10 min洗涤细胞一次,弃掉上清液后加入完全培养基重悬浮后,于28℃培养箱中培养。
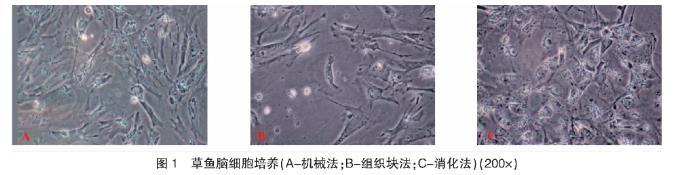
细胞活力测定
细胞活力测定采用CellTiter 96®AQueous One Solution Cell Proliferation Assay试剂盒测定。采用如1.3中机械破碎法制备细胞悬液,取出20μL细胞悬液,加入等体积的0.4%台盼蓝染液,利用血球计数板快速估算细胞密度以及检验细胞成活率[细胞成活率(%)=活细胞总数/(活细胞总数+死细胞总数)×100],当细胞活力大于90%时可用。用完全培养基将细胞稀释至2×106个/mL,细胞悬液分别接种到24孔及96孔细胞培养板,培养24 h后细胞贴壁稳定,在培养24、48、72、96、120 h后,分别计数其细胞数及测定其细胞活力。实验开始时,向培养板每孔中加入20μL CellTiter 96®AQueous One Solution Reagent溶液,黑暗中孵育4 h后终止培养,490 nm波长读取吸光度值。
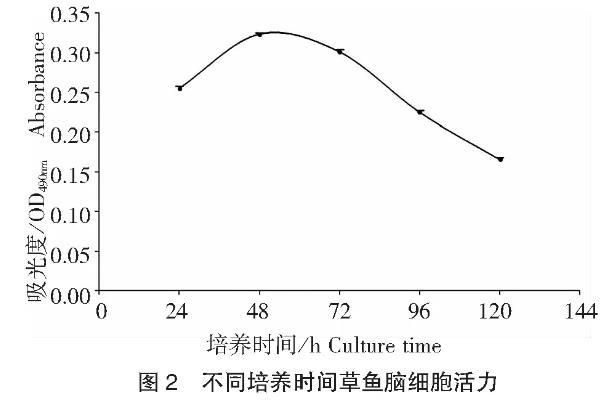
结果显示,原代脑细胞的活力可以稳定地保持3 d,超过3 d后,细胞明显退化。因此在当前培养条件下所制备的原代鱼脑细胞可用于部分生理机制的离体分析。近年来,国内外学者对鱼类脑细胞培养进行了大量研究。利用鱼类原代脑细胞进行离体测试已得到应用,主要包括鱼类病毒感染与细胞毒性实验,以及持久性有机污染物的毒理学相关研究;但是持久细胞系随着代数的增加,其细胞的基因型和表型都有可能发生改变,导致某些重要的生理功能和分化特征丧失,实验稳定性较差;而鱼类细胞的原代培养是从活体动物获取组织细胞后在体外进行的首次培养,细胞刚刚离体,生物性状尚未发生很大变化,大多数细胞表现出原有组织的特性,在一定程度上更能反映体内状态,测试的结果比较准确,重复性好。
